Comité d'Ètica de la Investigació amb medicaments (CEIm)
És l’organisme independent, constituït per professionals sanitaris i membres no sanitaris, encarregat de vetlar per la protecció dels drets, la seguretat i el benestar dels subjectes que participen en un assaig clínic, i d’oferir garantia pública respecte aquest tema.
La seua funció és la supervisió i el control continuat dels assajos clínics, que han de complir la normativa vigent pel que fa als aspectes metodològics i ètics.

CEIm FIVO
President:
D. Esteban Morcillo Sánchez (Farmacòleg clínic).
Vicepresident:
D. Ignacio Gil-Bazo (Metge especialista en Oncologia).
Secretari tècnic:
D. Carlos Andrés Blasco (Farmacèutic especialista en Farmàcia Hospitalària).
Vocals:
- Ismael Pastor Climente (Farmacèutic especialista en Farmàcia Hospitalària).
- Joaquín Gavilá Gregori (Metge especialista en Oncologia).
- Ángel Luis Guerrero Zotano (Metge especialista en Oncologia).
- Dª Lourdes Bello Luna (Llicenciada en Dret).
- Dª Mª José Ortega García (Llicenciada en Dret).
- Julio Tudela Cuenca (Farmacèutic especialista en Anàlisis clíniques).
- Jose Luis Trillo (Farmacèutic d’Atenció Primària).
- Luis Gómez De Membrillera Quesada (Especialista en Medicina Familiar i Comunitària).
- David Hervás Marín (Llicenciat en Bioestadística).
- Dª Josefina Balaguer Cusi (Membre llec).
- Esteban Mesas Plaza (Diplomat en Infermeria).
- Dª Elena Oliete Ramírez (Metge especialista en Medicina Familiar i Comunitària).
- Antonio José Revert Ventura (Metge especialista en Radiologia).
- Miguel Ángel Sanz Alonso (Metge especialista en Hematologia).
Coordinador Secretaria Tècnica CEIm:
Bernat Navarro Aguir (Llicenciat en Farmàcia)
La documentació a presentar per a l’avaluació d’assajos clínics amb medicaments/productes sanitaris és la indicada en el “Document d’instruccions de l’Agència Espanyola de Medicaments i Productes Sanitaris per a la realització d’assajos clínics a Espanya” i en el “Memoràndum de Col·laboració i Intercanvi d’Informació entre l’Agència Espanyola de Medicaments i Productes Sanitaris i els Comités d’Ètica de la Investigació amb medicaments”.
Documents de la part I per a enviar a l’AEMPS i al CEIm*
- Carta de presentació
- Formulari de sol·licitud
- Autorització del promotor al sol·licitant, si cal
- Resum de protocol
- Protocol
- Manual de l’investigador o fitxa tècnica del medicament en investigació
- Fitxa tècnica o manual de l’investigador dels medicaments no investigats (auxiliars)
- Assessorament científic i pla d’investigació pediàtrica
Documents de la part II per a enviar només al CEIm*
- Documents en relació als procediments i material utilitzat per al reclutament de subjectes
- Documents de fulles d’informació i consentiment informat
- Idoneïtat de l’investigador
Documentació a aportar per cada centre:
- Curriculum vitae IP
- Idoneïtat de les instal·lacions
- Conflicte interessos de l’IP
- Certificat BPC de l’IP
- Prova de la cobertura d’assegurança o garantia financera
- Memòria econòmica
- Formulari dades de facturació taxes CEIm. La factura s’emet després de completar el procés d’avaluació. Ha d’aportar-se el document complet juntament amb la sol·licitud. En el cas de sol·licitar exempció, veure condicions en el document.
Per als assajos clínics amb medicaments, el promotor ha de presentar la documentació a través del Portal d’assajos clínics del Ministeri de Sanitat, Política Social i Igualtat.
Per als assajos clínics amb productes sanitaris, el promotor ha de presentar la documentació escanejada per e-mail a l’adreça ceim@fivo.org. En aquest e-mail, el promotor ha d’indicar el títol de l’estudi, el codi de protocol, el promotor i l’investigador principal de FIVO (si cal).
El promotor ha de presentar tota la documentació escanejada (PDF) per e-mail a l’adreça ceim@fivo.org.
DOCUMENTACIÓ LOCAL (DESCARREGAR REQUISITS EOm):
En els casos dels EOm que en el moment de la seua presentació no disposen d’un dictamen favorable emés pel Comité d’Ètica de la Investigació amb medicaments (CEIm), s’haurà de presentar la següent documentació en format PDF per a la seua revisió pel CEIm-FIVO:
El promotor ha de presentar tota la documentació escanejada per e -mail a l’adreça ceim@fivo.org.
DOCUMENTACIÓ GENERAL (Només és necessària en PDF):
- Carta de presentació (signada). Mitjançant la qual se sol·licita l’avaluació al CEIm-FIVO. Ha d’especificar el promotor, el títol de l’estudi, el codi, l’investigador principal en el centre i la relació de la documentació que s’adjunta.
- Formulari de registre d’estudi d’àmbit intern i/o universitari (signat). Completar només en el cas que l’estudi siga d’àmbit intern i/o universitari.
- Protocol complet, adaptat en la mesura que siga possible a l’estructura i contingut que es detalla en l’annex I del Reial decret 957/2020, de 3 de novembre, pel qual es regulen els estudis observacionals amb medicaments d’ús humà. Podrà ser acceptat en anglés, amb un resum en la llengua oficial de l’Estat. S’indicarà la seua versió i data.
- Fulla d’informació per als subjectes participants i formulari de consentiment informat, o justificació de la seua exempció. Disponible model CEIm-FIVO. S’indicarà la seua versió i data.
- Quadern de recollida de dades (QRD).
- Memòria econòmica general. Fonts de finançament de l’estudi i compensacions previstes per als subjectes participants i investigadors, en el seu cas. En cas de tractar-se d’una investigació clínica sense ànim comercial, el promotor haurà de presentar una declaració responsable signada pel promotor i per l’investigador coordinador com que l’estudi compleix amb totes les condicions referides en el paràgraf e) de l’article 2.2 del Reial decret 1090/2015, de 4 de desembre.
- Llistat d’investigadors de cadascun dels centres sanitaris en els quals es proposa realitzar l’estudi i nombre de subjectes participants que es pretenen incloure en cada comunitat autònoma. Si l’estudi es preveu realitzar en altres països, llistat de països.
- Acord de delegació de responsabilitats (CRO) En cas que la sol·licitud no la presente el promotor, aquesta haurà d’incloure un document que indique les tasques delegades pel promotor a la persona o empresa que actua en el seu nom. (Si cal)
- Documentació de l’aprovació del protocol per l’òrgan corresponent, en el cas d’estudi imposat al titular d’autorització de comercialització d’un medicament per l’autoritat nacional competent o la Comissió Europea. (Si cal)
- Sol·licitud factura/Sol·licitud exempció tarifes avaluació (signada).
DOCUMENTACIÓ LOCAL (Es farà arribar a la Secretaria CEIm degudament SIGNADA, segons model propi del CEIm-FIVO):
NOTA:
- EOm promogut per promotor extern: La gestió d’aquesta documentació se sol·licitarà al coordinador de FINCIVO (coordinacion@fincivo.org) perquè la gestione i la faça arribar al promotor.
- EOm promogut per IP de FIVO: La gestionarà el propi investigador.
- Compromís de l’investigador i autorització del Cap de servici.
- Conformitat del servici implicat. Proves extraordinàries i /o col·laboració amb altres servicis (únicament quan calga).
- Formulari característiques generals de l’estudi.
- Qüestionari estudis amb memòria econòmica 0 €. Només en el cas d’estudis amb memòria econòmica 0 €.
- Compromís de confidencialitat destinat a alumnes en pràctiques. Només en el cas d’estudis d’àmbit universitari.
- Clàusula RGPD. Només en el cas d’estudis d’àmbit universitari.
L’estudi observacional amb medicaments (EOm) no podrà iniciar-se en el centre fins que no s’obtinga la corresponent conformitat de gerència (el promotor és personal FIVO) o se signe el contracte corresponent (el promotor és extern al centre). Per a això serà condició mínima necessària aportar justificació d’haver rebut les autoritzacions del finançament sol·licitat. Tant la conformitat d’adreça com el contracte ha de sol·licitar-se en el següent compte de correu electrònic: contratosestudios@fivo.org.
El promotor ha de presentar tota la documentació escanejada (PDF) per e-mail a la direcció ceim@fivo.org.
DOCUMENTACIÓ A PRESENTAR (DESCARREGAR REQUISITS PROJECTES EN PDF):
S’haurà de presentar la següent documentació EN FORMAT PDF per a la seua revisió pel CEI-FIVO:
DOCUMENTACIÓ GENERAL
1. Carta de presentació (signada). Mitjançant la qual se sol·licita l’avaluació al CEI-FIVO. Ha d’especificar el promotor, el títol de l’estudi, el codi, l’investigador principal en el centre i la relació de la documentació que s’adjunta.
3. 1 Resum del protocol.
5. Quadern de recollida de dades (QRD).
7. Informe de disponibilitat de mostres del BIOBANC (només si calen mostres del biobanc).
8. Certificat d’assegurança de responsabilitat civil (Art 18 llei 14/2007) (si cal).
9. Acord de delegació de responsabilitats, en el cas de CRO (si cal).
DOCUMENTACIÓ LOCAL (remetre un original segons model propi del CEIm-FIVO):
1. Compromís de l’investigador i autorització del Cap de servici.
2. CV de l’equip investigador (es recomana un format abreujat).
3. Conformitat del servici implicat. Proves extraordinàries i /o col·laboració amb altres servicis (únicament quan calga)
4. Informe de l’investigador principal.
5. Qüestionari estudis amb memòria econòmica 0 €. Només en el cas d’estudis amb memòria econòmica 0 €.
6. Compromís de confidencialitat destinat a alumnes en pràctiques. Només en el cas d’estudis d’àmbit universitari.
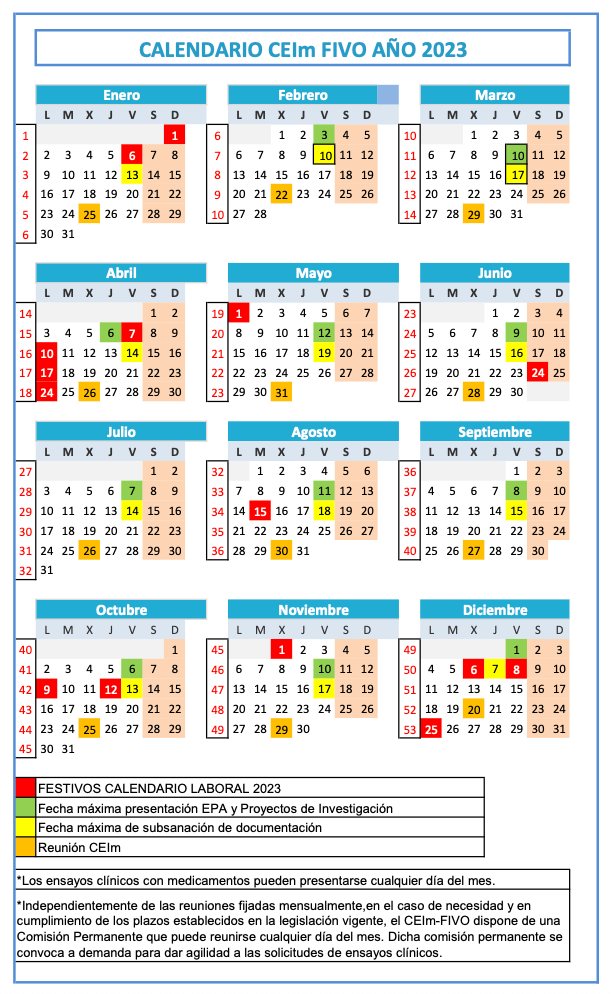
Termini de presentació: Del dia 1 al 10 de cada mes. Es podrà esmenar documentació fins al dia 15.
Secretaria Tècnica CEIm
Bernat Navarro, Beatriz Llatas i Carmen Taltavull
E-mail: ceim@fivo.org
Telèfon: 96 069 4674 | 96 110 4673 | 96 111 4095
Direcció: Gregorio Gea, 31 | 46009 VALÈNCIA
Edifici D, 1ª Planta – Secretaria Tècnica CEIm
Gestió de contractes d'estudis clínics
En la Fundació Institut Valencià d’Oncologia, el Director mèdic és la persona autoritzada per a signar el document d’idoneïtat de les instal·lacions.
Per a sol·licitar la tramitació de signatura d’aquest document, el promotor/CRO pot enviar un correu electrònic a: contratosestudios@fivo.org.
Amb la sol·licitud s’haurà d’adjuntar la següent documentació i informació (DESCARREGAR REQUISITS GESTIÓ IDONEÏTAT INSTAL·LACIONS EN PDF):
- Protocol en castellà, o protocol en anglès i sinopsis en castellà.
- Model d’idoneïtat de les instal·lacions emplenat amb les dades de l’estudi i on s’indiquen els servicis participants en l’estudi.
- Memòria econòmica general
A més, en el correu electrònic de sol·licitud s’han d’indicar les dades següents:
- Nom de l’investigador principal
- Servici de l’hospital en el qual es realitzarà l’estudi
- Si necessiten el document amb signatura original o és suficient amb l’escaneig en PDF
Els contractes d’assajos clínics que se signen amb la Fundació Institut Valencià d’Oncologia es gestionaran segons les instruccions que es descriuen a continuació.
El correu electrònic de contacte per a la negociació dels contractes és contratosestudios@fivo.org.
La documentació i la informació que haurà d’aportar el promotor per a completar l’expedient intern del centre és la següent: (DESCARREGAR REQUISITS GESTIÓ CONTRACTES EECC EN PDF):
1. Protocol en anglés o castellà
2. Resum del protocol en castellà.
3. Fulla d’informació al pacient/Consentiment informat
4. Annex 1A (si està disponible en el moment de la signatura)
5. Certificat pòlissa d’assegurança. Ha de constar la següent informació:
Centre: Fundació Institut Valencià d’Oncologia
Direcció del centre: C/ Profesor Beltrán Báguena, 8 | 46009 València
Fundació: Fundació d’Investigació Clínica de l’Institut Valencià d’Oncologia (FINCIVO)
Direcció de la fundació: C/ Ricardo Micó, nº 3 – Local nº 1 | 46009 València
Investigador principal.
7. Poders/delegació (CRO). Justificació de la representació de les parts signants en el contracte.
8. Dictamen CEIm (si està disponible en el moment de la signatura)
9. Autorització AEMPS (si està disponible en el moment de la signatura)
10. CV de l’IP
12. Nom del CEIm i estat de la sol·licitud al CEIm i a l’AEMPS. Completar formulari adjunt.
MEMÒRIA ECONÒMICA LOCAL
De manera simultània, s’ha de negociar l’annex de la memòria econòmica local amb Bernat Navarro bnavarro@fivo.org (TELÈFON: 96 069 4674). Depenent de com se signarà el contracte s’ha d’utilitzar un dels següents models:
– Model Annex Memòria Econòmica interna FIVO contracte castellà.
– Model Annex Memòria Econòmica interna FIVO contracte bilingüe.
SÓN DOS PROCESSOS GESTIONATS DE MANERA INDEPENDENT
– El cos del contracte es negocia en contratosestudios@fivo.org (No posar en còpia a aquesta adreça en els correus que van dirigits a la negociació de la memòria econòmica local).
– La memòria econòmica local es negocia directament amb bnavarro@fivo.org (No posar en còpia a aquesta adreça en els correus que van dirigits a la negociació del cos del contracte). Una vegada tancat l’annex de memòria econòmica local, podrà ser bolcat en el contracte.
Després de la publicació del Decret 73/2009, de 5 de juny, del Consell, pel qual es regula la gestió d’assajos clínics i estudis postautorització observacionals amb medicaments i productes sanitaris [2009/6667], s’utilitzaran els següents models de contracte:
- MODEL CONTRACTE EC FIVO CASTELLÀ
- MODEL CONTRACTE EC FIVO BILINGÜE
- MODEL CONTRACTE EPA FIVO CASTELLÀ
- MODEL CONTRACTE PROJECTES FIVO CASTELLÀ
En cas de produir-se una extensió de l’estudi clínic, un canvi d’investigador principal o bé una modificació rellevant que porte implícit un augment o disminució del cost de l’estudi clínic inicialment previst, es realitzarà una addenda al contracte.
S’utilitzaran els següents models d’addendes:
*En el cas que siga necessari signar l’addenda en bilingüe, es requereix aportar traducció jurada, junt amb el certificat de traductor jurat acreditat pel Ministeri d’Afers Exteriors.
Secretaria Investigació FIVO
Bernat Navarro, Beatriz Llatas i Carmen Taltavull
E-mail: contratosestudios@fivo.org
Telèfon: 96 110 4673 | 96 111 4095
Direcció: Gregorio Gea, 31 | 46009 VALÈNCIA
Edifici D, 1ª Planta – Secretaria Investigació FIVO
Assajos clínics en l'IVO
L’Institut Valencià d’Oncologia ha participat en el desenvolupament de gran part dels nous fàrmacs contra el càncer comercialitzats en els darrers 20 anys i actualment és un dels centres del país que compta amb més assajos clínics amb fàrmacs oncològics.





